Серед дітей і підлітків відзначається значне зростання рівня поширеності поєднаної патології — цукрового діабету (ЦД) та автоімунного тиреоїдиту (АІТ). Це призводить до значного погіршення перебігу та прогнозу захворювання. Незважаючи на важливість проблеми, на сьогодні відсутні достатньо ефективні схеми та методи лікування цієї патології. Тому виникає необхідність пошуку нових патогенетичних підходів щодо корекції цих захворювань.
Проблема ендокринологічної патології має важливе соціально-медичне значення. Це пов’язано з тим, що внаслідок захворювання ендокринних органів розвиваються ускладнення, які з часом формують цілий пласт поєднаної патології.
На сьогодні найбільший відсоток хворих із патологією ендокринної системи становлять діти та підлітки, хворі на ЦД [8]. Поширеність становить 9,81 випадку на 10 000 населення. При цьому відмічається тенденція до подальшого зростання захворюваності. Так, в Україні за попередні 5 років захворюваність на ЦД серед дітей дошкільного віку зросла в 1,5 раза.
Досить часто в клінічній практиці лікарі зустрічаються з поєднаною патологією, коли ЦД супроводжує АІТ, що призводить до значного погіршення якості життя пацієнтів.
Поширеність АІТ серед дитячого населення становить 0,1–1,2 %. Перебіг захворювання поступово призводить до зниження функцій щитоподібної залози, що варіює від еутиреоїдного стану до явного гіпотиреозу, а це негативно позначається на рості, статевому дозріванні та інтелектуальному розвитку дітей і підлітків.
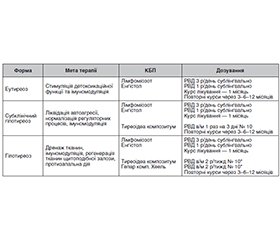
Межову позицію між нормою і клінічно вираженою формою гіпотиреозу займає субклінічний гіпотиреоз — стан, за якого в крові визначається нормальний вміст загального і вільного тироксину (Т4) на тлі підвищеного рівня тиреотропного гормону (ТТГ) гіпофіза [7]. Діаг–ностика субклінічного гіпотиреозу не викликає труднощів. Проте дуже часто лікарі різних спеціальностей стикаються з проблемою «маскування» цієї патології. Субклінічний гіпотиреоз можна запідозрити за відсутності ефекту терапії захворювання, клінічно не пов’язаного, на перший погляд, із порушеннями функції щитоподібної залози (табл. 1).
Патогенетичні зміни в щитоподібній і підшлунковій залозах, що розвиваються за АІТ і ЦД 1-го типу, проходять у своєму розвитку низку стадій:
— вплив індукторів автоімунного походження тканин із щитоподібної залози та бета-клітин підшлункової залози призводить до появи автоантитіл і сенсибілізованих лімфоцитів (доклінічна фаза захворювання);
— запалення в тканинах щитоподібної та підшлункової залоз через накопичення імунних комплексів, що призводить до подальших деструктивних процесів у тканинах;
— метаболічна блокада клітин і, як наслідок, накопичення продуктів внутрішньоклітинного метаболізму та ураження клітинних структур, що призводить до зміни функцій органа (щитоподібної та підшлункової залоз) і організму в цілому.
В основі базисної терапії АІТ і ЦД лежить замісна терапія органоспецифічними гормонами, яка, маючи більшою мірою симптоматичний характер, не передбачає впливу на основні ланки патогенезу захворювань. Подібна терапія чинить пригнічувальну і блокуючу дію (пригнічує продукцію автоантитіл, чинить ТТГ-супресивну дію), що в більшості випадків робить лікування неефективним.
Таким чином, незважаючи на важливість проблеми, на сьогодні відсутні достатньо дієві патогенетичні методи лікування цієї патології. Також немає єдиної думки фахівців щодо зменшення імунологічних порушень в умовах розвитку АІТ та профілактики гіпотирео–зу в таких хворих. Тому виникає необхідність пошуку нових лікувальних підходів, які були б не тільки дієвими в патогенетичному та симптоматичному планах, а й не мали б негативних наслідків при їхньому застосуванні, що особливо важливо в лікуванні дітей та підлітків.
На сучасному етапі спостерігають тенденцію дедалі більшої інтеграції нетрадиційної та академічної медицини. У розвинених європейських країнах методи біологічної медицини, що полягають у впливі на системи регуляції та реактивності організму лікарськими препаратами природного походження і фізіотерапевтичними методами, дедалі частіше використовують у комплексі з алопатичним лікуванням, протоколами лікування.
Особливий інтерес у сучасного лікаря викликає один із методів біологічної медицини — патогенетична біорегуляційна терапія, що ґрунтується на принципах цілісного підходу до діагностики (зокрема, типових патологічних процесів (ТПП)) та лікування пацієнта і впливає на різні етапи розвитку патологічного процесу в організмі.
Патогенетичний принцип реалізується шляхом комплексного впливу біорегуляційної терапії на ТПП, що лежать в основі розвитку всіх захворювань. Це надає можливість здійснювати прицільний вплив на патогенез захворювання, а не тільки на його клінічні прояви.
Пригнічення симптоматики, притаманне засобам класичної (протокольної) медицини, часто є пусковим або обтяжувальним фактором подальшого розвитку захворювання, що може проявлятися не тільки розвитком ускладнень, а й формуванням асоційованих і коморбідних станів.
Одним із нових патогенетичних підходів до корекції ендокринних захворювань є застосування КБП ТМ Heel у поєднанні з базисною терапією. Ефективність цього підходу доведена низкою досліджень.
Наприклад, під керівництвом А.Л. Резнікової на базі Запорізького державного медичного університету було проведено роботу з вивчення ефективності КБП у комплексному лікуванні дітей і підлітків з АІТ [1]. Актуальність цього дослідження визначена необхідністю пошуку більш ефективних та безпечних схем лікування АІТ у дітей. Комплексна терапія цієї патології повинна передбачати використання не лише замісної гормональної терапії, а й призначення засобів з імунокорегувальною та протизапальною дією, тим самим вирішувати основні патогенетичні завдання.
Метою цієї роботи було вивчення ефективності застосування КБП Тиреоідеа композитум у комплексному лікуванні АІТ. Препарат регулює функції щитоподібної залози, сприяє нормальному диференціюванню клітин, оптимізує метаболізм у зрілих клітинах ЩЗ, сприяє фізіологічній регенерації тканини щитоподібної залози, усуває блокаду ферментів і відновлює нормальну швидкість внутрішньоклітинних біохімічних реакцій. Усе це дало підстави припустити, що застосування Тиреоідеа композитум дозволить реалізувати важливі патогенетичні завдання терапії.
Результати проведеної роботи показали, що при використанні Тиреоідеа композитум значно зменшуються суб’єктивні прояви АІТ. Також використання Тиреоідеа композитум у складі стандартних схем лікування призводить до нормалізації функцій щитоподібної залози, тим самим істотно доповнюючи базисне лікування АІТ. У ході лікування у пацієнтів були відсутні побічні ефекти (включно з алергічними реакціями).
Наукова робота «Лімфотерапія діабетичної полінейропатії — практичне дослідження терапії матриксу при цукровому діабеті» німецької дослідниці А.-Р. Дітц у 1999 році була відзначена Міжнародною премією ім. Г.-Г. Реккевега [2].
Діабетична полінейропатія є найтяжчим та найпоширенішим ускладненням ЦД, що веде до ранньої інва–лідизації пацієнтів. Серед клінічних проявів на ранніх стадіях полінейропатії поряд із порушеннями чутливості відзначають набряк гомілок і стоп. Тому застосування КБП Лімфоміозот, що активує лімфовідтік із тканин, патогенетично обґрунтоване.
У своїй роботі А.-Р. Дітц вивчала ефективність застосування препарату Лімфоміозот у комплексному лікуванні діабетичної полінейропатії. Результати цієї роботи показали, що застосування КБП Лімфоміозот у стандартній схемі лікування ЦД оптимізує профілактику та лікування його нейрогенних ускладнень, оскільки сприяє зниженню ризику виникнення та поліпшенню прогнозу перебігу судинних, лімфатичних і нейрогенних порушень [2].
О.І. Кондратьєва з групою колег-науковців вивчали ефективність реабілітації дітей із ЦД 1-го типу з використанням КБП [3]. Відомо, що печінка відіграє провідну роль в обміні вуглеводів та інсуліну, тому вкрай важливим є підтримання її функції для компенсації ЦД і профілактики його ускладнень.
Метою цієї роботи було вивчення впливу різних схем гепатотропної терапії на клінічний перебіг і стан процесів перекисного окиснення в дітей із ЦД 1-го типу. В одній зі схем використовували Гепар композитум (сучасна назва — Гепар комп. Хеель) і Хепель — КБП з антиоксидантними та гепатопротекторними властивостями.
У дослідженні було встановлено, що застосування Гепар композитум і Хепель сприяє стабілізації клітинних мембран і чинить виражену антиоксидантну дію. Науковці дійшли висновку, що включення цих КБП до стандартних схем терапії хворих із ЦД 1-го типу оптимізує його лікування, забезпечуючи безпеку та ефективність.
На базі Київського інституту ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України було проведено дослідження [4], під час якого вивчали можливості застосування КБП Убіхінон композитум у терапії кетоацидозу в дітей, хворих на ЦД 1-го типу, оскільки існуючі схеми лікування досить повільно впливають на усунення кетоацидозу та відновлення метаболізму.
У результаті проведеної роботи було зроблено висновки, що з метою прискорення термінів усунення кетоацидозу та запобігання подальшим ускладненням раціонально застосовувати Убіхінон композитум, оскільки цей КБП прискорює ліквідацію метаболічних порушень (зменшення глікемії, глюкоземії, ацетонурії спостерігалося вже після 2–4 ін’єкцій), сприяє поліпшенню вуглеводного обміну, знижує ризик розвитку ускладнень [4].
З огляду на досвід призначення КБП при ЦД 1-го типу та АІТ було запропоновано загальні практичні рекомендації щодо оптимізації лікування.
У результаті застосування КБП при АІТ (табл. 2) припиняється руйнування фолікулів щитоподібної залози. Активація гуморальних імунологічних реакцій сприяє пригніченню реакцій клітинного імунітету (реверсія імунної відповіді), характерних для АІТ, що веде до зниження автоімунної агресії і, як наслідок, до пригнічення процесів утворення різних ефекторів імунних реакцій [4].
Також ефективним є застосування КБП для терапії та профілактики ускладнень ЦД (табл. 3). Це зумовлено тим, що КБП посилюють чутливість до препаратів стандартної терапії ЦД, що веде до зниження медикаментозного навантаження і підвищення ефективності терапії [5].
Актуальність ранньої діагностики та пошуку най–оптимальніших методів лікування ЦД 1-го типу, асоційованого з АІТ, у дітей і підлітків не піддається сумніву, оскільки є великий ризик розвитку порушень інтелектуального та статевого розвитку, репродуктивної функції.
Висновки
В основі більшості захворювань, незалежно від структурно-функціональних особливостей тканини, лежить певний набір ТПП, які реалізуються в більшості випадків через механізми запалення і дистрофії. Метою патогенетичної біорегуляційної терапії є вплив на механізм розвитку захворювання, а не усунення симптоматики, що запобігає виникненню асоційованих станів. Вона впливає на весь організм загалом, а не тільки на один орган або одну систему, в даному випадку ендокринну, що надає можливість запобігти розвитку ускладнень і виникненню поліморбідних станів.
Отже, застосування патогенетичної біорегуляційної терапії у складі стандартних схем сприяє підвищенню ефективності та безпеки проведеного лікування. З огляду на все вищевикладене очевидно, що застосування у складі базисної терапії АІТ і ЦД комплексних біорегуляційних препаратів ТМ Heel дозволяє оптимізувати терапію ендокринологічних захворювань у дітей.

/26.jpg)
/27.jpg)