Вступ
Одним з головних завдань під час хірургічного лікування є відновлення кістки, що була уражена пухлинним процесом. Від успіху оперативного втручання, яке було проведено, залежить онкологічний та функціональний результат лікування хворих з пухлинами довгих кісток. Методів заміщення післярезекційних дефектів довгих кісток існує багато, але найбільшого поширення отримали модульне індивідуальне ендопротезування та біореконструктивні втручання [1]. Саме біореконструктивні операції мають низку переваг перед модульним ендопротезуванням, і одним із головних є відновлення кісткової тканини та зон прикріплення м’язів і сухожиль [2]. Алопластичне заміщення кісткових дефектів після видалення пухлин є часто вживаним і досить успішним методом хірургічного лікування хворих з онкологічною патологією. Поряд з великими перевагами цього методу існує і низка недоліків та ускладнень, серед яких — відсутність зрощення кістки реципієнта та алоімплантата. Усі переломи алотрансплантатів — складна проблема для онкологічних пацієнтів [3, 4]. Тому суворе дотримання методики імплантації алотрансплантата та методів фіксації дозволяє зменшити ризик виникнення таких ускладнень.
У сучасному світі дуже цінується час активного життя людини, тому важливим питанням стало відновити функцію ураженої кінцівки пацієнта у максимально короткий термін. З цією метою великі сегментарні кісткові алоімплантати фіксуються до кістки реципієнта різними металевими конструкціями, як накісними, так і інтрамедулярними [5, 6].
Вивчення та вирішення питання з’єднання алотрансплантата з кісткою реципієнта, процесів репарації в цій зоні, відносин між алотрансплантатом та ендопротезом дозволять досягнути поліпшення результатів хірургічного лікування хворих з кістковими пухлинами завдяки зменшенню відсотка таких ускладнень, як переломи алоімплантатів, відсутність зрощення алоімплантата та кістки реципієнта (порушення процесу репаративного остеогенезу) [7, 8].
Зважаючи на наведене вище, для оцінки ефективності оперативного втручання, що було проведено, важливо оцінити стан кісткової тканини. Щільність кісткової тканини є одним із основних показників, який визначає міцність кістки, її стійкість до механічного навантаження. Для цього існують рентгенологічні шкали оцінки та денситометричні методи.
Для рентгенологічної оцінки стану алокомпозитного ендопротезування прийнято застосовувати радіографічну систему ISOLS (International society of limb salvage) [9]. Виконується оцінка декількох факторів:
— ремоделювання кістки (досліджується зона контакту алотрансплантата та кістки реципієнта);
— зона контакту ніжки ендопротеза з кісткою (оцінюється контакт поверхні ніжки ендопротеза та кістки);
— якість фіксації ендопротеза у кістці;
— зрощення алотрансплантата та кістки реципієнта;
— резорбція в зоні контакту алотрансплантата та кістки реципієнта;
— переломи алотрансплантатів.
Кожен з цих факторів оцінюється як «відмінно», «добре», «задовільно» та «погано».
Для діагностики стану кісткової тканини, її щільності використовують рентгенологічне, денситометричне дослідження або КТ. Рентгенівські промені мають високу проникність, але проходять через тканини різної щільності нерівномірно. На цій особливості засновано вимірювання кісткової щільності. Такий метод дозволяє оцінити структуру кістки, стан її перебудови у разі кісткової пластики або переломів, виявити патологічні процеси.
Таким чином, на сучасному етапі продовжуються дослідження з виявлення найкращого методу кісткової алопластики для зменшення різних ускладнень цього виду заміщення післярезекційних дефектів довгих кісток, а використання методики дослідження рентгенологічної щільності за допомогою програмного комплексу Х-Rays дозволить оцінити стан кісткової тканини у разі застосування цього методу хірургічного втручання.
Мета роботи: оцінити можливості методики дослідження рентгенологічної щільності за допомогою програмного комплексу Х-Rays у разі сегментарної кісткової алопластики післярезекційних дефектів довгих кісток в експерименті та в клініці з метою виявлення найкращих методів фіксації сегментарних алоімплантатів.
Матеріали та методи
У цій роботі нами об’єднані 2 дослідження (експериментальне на дослідних тваринах та клінічне дослідження), які показують результати застосування різних методів кісткової алопластики та кореляцію даних експерименту та клінічної практики за даними рентгенологічної щільності. Окремо ці дослідження докладно подані у наших попередніх публікаціях [10, 11].
Експериментальна частина дослідження
Робота виконана на 60 лабораторних білих щурах-самцях (вік — 5 міс., жива маса тіла — 350–400 г) популяції експериментально-біологічної клініки ДУ «ІПХС ім. проф. М.І. Ситенка НАМНУ». Експеримент на щурах проведений із дотриманням вимог Європейської конвенції про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей (Страсбург, 1986) [12] та Закону України «Про захист тварин від жорстокого поводження» (ст. 26) [13].
Усі хірургічні втручання виконували в умовах асептики та антисептики під загальним знеболюванням: аміназин (10 мг/кг живої маси, в/м) та кетамін (50 мг/кг живої маси, в/м). План експерименту затверджений на засіданні комітету з біоетики інституту (протокол № 204 від 15.06.2020 р), а також отримано позитивне рішення щодо відповідності виконаного дослідження сучасним вимогам біоетики (протокол № 227 від 28.11.2022 р.).
Тварин розподілили на дві групи: у 1-й групі тварин виконали поперечну остеотомію стегнової кістки з імплантацією алокомпозитного ендопротеза (30 тварин) (рис. 1); у 2-й групі виконали східцеподібну остеотомію стегнової кістки з імплантацією алокомпозитного ендопротеза (30 тварин) (рис. 2).
Для дослідження використовували цифрові рентгенограми щурів.
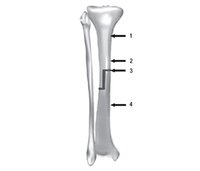
Після виведення тварин з експерименту (через 6 міс.) виділяли препарати оперованих стегнових кісток, після чого виконували їх одномоментний рентгенівський знімок (рис. 3, 4). Виконання знімка препаратів одним кадром дозволило запобігти похибці вимірювань, пов’язаній з розбіжністю якості знімків (яскравість, контрастність та ін.). На рентгенологічних знімках препаратів стегнових кісток вимірювали оптичну щільність кісткового регенерату (зону контакту алоімплантата та кістки реципієнта) та кіркового шару кістки реципієнта нижче від дистального кінця ендопротеза (рис. 5).
/46.jpg)
Вимірювання проводили за допомогою програмного комплексу Х-Rays, розробленого в Харківському національному університеті радіоелектроніки [1]. Дані експерименту були оброблені статистично. Розраховували середнє значення (М) та його стандартне відхилення (SD) чи стандартну похибку (SE), а також мінімальне та максимальне значення. У межах одної групи проводили порівняння за допомогою парного Т-тесту (регенерат/кістка реципієнта), порівняння між групами — за допомогою Т-тесту для незалежних вибірок з розрахунком різниці середніх ((M ± SE) або (M ± SD)), критичного значення тесту (t) та статистичної значущості (p). Аналіз даних проводили в пакеті для статистичного аналізу IBM Statistic SPSS 20.0.
Клінічні дослідження
Рентгенометричне дослідження оптичної щільності кісткової тканини у пацієнтів, яким було виконане оперативне втручання з приводу пухлин кісток, проводилося у лабораторії біомеханіки ДУ «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка НАМН України». Усім хворим було виконано видалення пухлини en block та заміщення післярезекційного дефекту довгої кістки сегментарним кістковим алоімплантатом, що був фіксований різними методами. Дослідження проводили за допомогою програмного комплексу X-Rays. Проаналізовано рентгенограми 13 пацієнтів, яким виконано сегментарну кісткову алопластику післярезекційних дефектів довгих кісток з фіксацією пластинами або блокуючими інтрамедулярними стрижнями, а також застосовувалися додатково у зоні контакту алоімплантата та кістки реципієнта кісткові автотрансплантати.
Розподіл пацієнтів за локалізацією вогнища та методом фіксації сегментарного алоімплантата був наступний: 6 (46,2 %) пацієнтів з локалізацією пухлинного процесу у стегновій кістці, 7 (53,8 %) — у великогомілковій кістці. Переважно уражалися метадіафізарні частини довгих кісток. Метод фіксації алоімплантата за допомогою інтрамедулярних блокуючих стрижнів застосовано у 6 випадках (46,2 %), а метод, який передбачав фіксацію алоімплантатів пластинами, — у 7 випадках (53,8 %) (табл. 1). Враховуючи результати експериментального дослідження та кращі результати у разі використання східцеподібної остеотомії кістки реципієнта та алоімплантата, всім пацієнтам виконувалась саме ця остеотомія.
/46_2.jpg)
Ретроспективно досліджували оптичну щільність кіркового шару у 4 точках: 1 — кістка реципієнта на 10 см від зони остеотомії, 2 — кістка реципієнта на 2 см від зони остеотомії, 3 — зона контакту кісткового алоімплантата та кістки реципієнта та 4 — кірковий шар алоімплантата (рис. 6). Оцінка даних проводилась у 3 терміни: 1 — після оперативного втручання, 2 — через 1 місяць після операції, 3 — через 5–12 місяців після операції.
Отримані дані оброблені статистично. Оцінку оптичної щільності у пацієнтів проводили із розрахуванням середнього (М) вибірки та його стандартного відхилення (SD). Порівняння двох груп проводили за допомогою Т-тесту для незалежних вибірок, оцінку повторних вимірювань (три періоди спостережень) проводили за методом загальної лінійної моделі (ЗЛМ) для повторних спостережень (критерій Піллая (F, р)).
Результати
Результати експериментального дослідження
Після виконання алокомпозитного ендопротезування (in vivo) з поперечною остеотомією (1-ша група) абсолютні значення оптичної щільності регенерату та кісткової тканини реципієнта становили 161 ± 19 од. та 222 ± 12 од. відповідно. Після використання східцеподібної остеотомії для з’єднання кістки реципієнта та алоімплантата (2-га група) ці показники були на рівні 216 ± 26 од. для регенерату та 230 ± 25 од. для кістки реципієнта. У 2-й групи щурів (зі східцеподібною остеотомією) щільність кісткового регенерату більш наближена до щільності кісткової тканини реципієнта, про що свідчить показник різниці середніх: –13,8 ± 6,3 од. проти –61,0 ± 16,5 од. для 1-ї групи тварин (табл. 2).
/47_2.jpg)
Таким чином, через 6 міс. після алокомпозитного ендопротезування стегнових кісток щурів оптична щільність кістки реципієнта не має статистично значущих відмінностей (p = 0,373) залежно від методу, що був застосований в обох групах тварин. Але показники оптичної щільності кісткового регенерату (зона контакту алоімплантата та кістки реципієнта, 216 ± 26 од.) у 2-й групи тварин (із застосуванням східцеподібної остеотомії) наблизилися до показників оптичної щільності кістки реципієнта. У 1-й групі тварин (з використанням поперечної остеотомії) оптична щільність кісткового регенерату статистично вірогідно нижча (p = 0,001), ніж у 2-й групі, і становить 161 ± 19 од.
Ці дані свідчать про те, що виконання східцеподібної остеотомії для з’єднання кістки реципієнта з кістковим сегментарним алоімплантатом сприяє скорішому набуванню щільності кісткового регенерату.
Результати клінічного дослідження
У досліджуваній групі пацієнтів, яким аналізували оптичну щільність за рентгенограмами, у 3 випадках не відзначалося зрощення кістки реципієнта та алоімплантата. Переважно це були пацієнти з ураженням патологічним процесом стегнової кістки, і у цих випадках застосовувався накістковий остеосинтез для фіксації алоімплантата. У пацієнтів з локалізацією пухлинного процесу у великогомілковій кістці ускладнень з порушенням консолідації не було відзначено. Проведено порівняльний аналіз значень оптичної щільності кісткової тканини у пацієнтів з наявністю зрощення кістки реципієнта та алоімплантата або з відсутністю консолідації фрагментів.
У результаті проведеного статистичного аналізу було доведено деякі особливості поведінки кісткової тканини у хворих із консолідованою та неконсолідованою зоною контакту алоімплантата та кістки реципієнта (табл. 3).
На 1-му терміні спостереження (після операції) було виявлено, що у хворих з відсутністю зрощення оптична щільність зони контакту (точка 3) була значущо (р = 0,044) меншою (99 ± 18 од.), ніж у хворих з нормальною консолідацією (160 ± 40 од.). Це свідчить про нещільний контакт між кісткою реципієнта та алоімплантатом під час оперативного втручання. Далі з часом (на 2-му та 3-му термінах спостереження) оптична щільність зони контакту (точка 3) у хворих із зрощенням залишалася практично незмінною — від 160 ± 40 од.
до 167 ± 52 од., тоді як при незрощенні ця зона поступово набирає щільності від 99 ± 18 од. до 172 ± 7 од.
/48.jpg)
За даними ЗЛМ, різниці у динаміці щільності зони контакту немає (F = 1,985; p = 0,232), через 1 рік після операції оптична щільність в обох групах наближається до близьких рівнів. У разі аналізу оптичної щільності кіркового шару кістки реципієнта у точці 1 (на 10 см від зони остеотомії) у пацієнтів, у яких була відсутня консолідація кістки реципієнта та алоімплантата, спостерігається поступове зменшення щільності з 171 ± 11 од. до 163 ± 14 од. (р = 0,042 та р = 0,05 відповідно) за весь період спостереження. У пацієнтів із нормальним зрощенням кістки реципієнта та алоімплантата щільність у цій зоні залишається практично однаковою, у межах 200 од. Оптична щільність кісткової тканини алоімплантата (точка 4) у пацієнтів обох підгруп з часом зростає, однак у пацієнтів зі зрощенням цей процес відбувається більш стрімкими темпами, але має однаковий напрямок розвитку, що і обумовило відсутність різниці в динаміці (F = 0,462; p = 0,534). Це свідчить про кращу перебудову кісткового алоімплантата у разі наявності його консолідації та кістки реципієнта.
Проаналізуємо зміну даних оптичної щільності кісткової тканини у разі застосування різних методів фіксації кісткового алоімплантата з кісткою реципієнта: за допомогою інтрамедулярного стрижня та за допомогою пластини (табл. 4).
Порівнюючи різниці показників, виявили статистично значуще збільшення показника оптичної щільності кіркового шару алоімплантата в ділянці стегна (в точці 4) в 3-му терміні проти вихідного рівня на відміну від сегмента гомілки (U = 5,00, Z = 2,21, p = 0,027). Порівнюючи різниці показників, виявили статистично значущі вищі показники оптичної щільності в точці 3 в 3-му терміні проти вихідного рівня у групі пацієнтів, у яких не досягнуто консолідації, порівняно із групою пацієнтів із підтвердженою консолідацією кістки реципієнта та сегментарного алоімплантата (U = 0,00, Z = –2,45, p = 0,014).
Аналіз зміни оптичної щільності зони контакту алоімплантата та кістки реципієнта (точка 3) показав, що первинно після операції її щільність у разі застосування пластини для фіксації алоімплантата була меншою (98 ± 46 од.) порівняно з даними рентгенограм пацієнтів, яким було виконано фіксацію інтрамедулярним блокуючим стрижнем (121 ± 44 од.).
Обговорення
Останніми роками для заміщення великих післярезекційних дефектів довгих кісток найбільш поширеним стає застосування масивних алотрансплантатів у комбінації з ендопротезами — алокомпозитного ендопротезування. Застосування цієї методики хірургічного втручання дозволяє зменшити ризики виникнення ускладнень у разі тільки алопластики або тільки ендопротезування [5].
Використання сегментарних алоімплантатів супроводжується низкою ускладнень, що характерні саме для цього методу заміщення післярезекційних дефектів довгих кісток [14]. Найчастішими з них є відсутність зрощення алоімплантата та кістки реципієнта, лізис і переломи алоімплантата, а у разі алокомпозитного ендопротезування — нестабільність ендопротеза [15]. Важливим питанням у разі алокомпозитного ендопротезування є надійність методу фіксації сегментарного алоімплантата та кістки реципієнта. Багатьма авторами доведено, що стабільна фіксація алоімплантата та його щільне прилягання до кістки реципієнта дозволяє досягнути їхнього зрощення. Існує декілька методик фіксації кісток у разі алокомпозитного ендопротезування. Важливим для прогнозування розвитку несправжнього суглоба є тип з’єднання між донорською кісткою та кісткою реципієнта. R. Capanna [16] визначив три основні типи з’єднання як базові: кірково-кірковий, кірково-губчастий та губчасто-губчастий. Він встановив 50 % кірково-кіркових зрощень, 91 % — кірково-губчастих та усіх губчасто-губчастих з’єднань за умов післяопераційної ПХТ. Відомо, що у разі тісного контакту між зіставленими фрагментами в кірковому шарі діафіза кістки частота зрощень зростає. Якщо розмір щілини перевищує 1 мм, частота зрощення значно зменшується. Клінічні дослідження показали, що для кращого зрощення слід застосовувати ригідну фіксацію. Також для стабілізації використовують накісткові пластини та інтрамедулярні фіксатори. Але частота переломів алотрансплантатів зростає після фіксації пластиною. Інтрамедулярна фіксація, навіть із проксимальним та дистальним блокуванням, може не забезпечити адекватних умов для зрощення. Інтрамедулярний стрижень із блокуванням є недостатньо ефективним для зрощення в діафізі довгої кістки: несправжні суглоби виникли у всіх 12 випадках такої фіксації. Тому досить ефективно застосувати малі компресійні пластини в місцях остеотомії разом з інтрамедулярним стрижнем. Додатковим методом зменшення ризику утворення несправжнього суглоба є введення у зону остеотомії подрібнених авто- чи алотрансплантатів. Часто з цією метою застосовують демінералізований кістковий матрикс. Проте такі додаткові методи не мають великого значення, якщо пацієнт має злоякісну пухлину і отримує ад’ювантну ПХТ [17].
У наведеній роботі порівняно результати застосування східцеподібної остеотомії для з’єднання алоімплантата та кістки реципієнта у разі різних методів фіксації. Результати проведеного нами дослідження наочно висвітлили той факт, що при алокомпозитному ендопротезуванні довгої кістки виконання східцеподібної остеотомії для з’єднання кістки реципієнта з кістковим сегментарним алоімплантатом сприяє скорішому набуванню щільності кісткового регенерату.
Більш стабільна фіксація кісткового алоімплантата із кісткою реципієнта, а також збільшення площини контакту цих кісток за рахунок використання східцеподібної остеотомії кісток, що з’єднуються, обумовлюють отримання найбільшої оптичної щільності кісткового регенерату.
Відсутність консолідації алоімплантата та кістки реципієнта спостерігали виключно в разі застосування методики фіксації алоімплантата пластинами. У цих випадках визначена знижена оптична щільність у зоні контакту алоімплантата та кістки реципієнта відразу після операції, що можна пояснити нещільним контактом між кісткою та сегментарним алоімплантатом. Незважаючи на те, що з часом зона контакту зміцнюється, міцність новоутвореного кісткового регенерату не забезпечує достатню стабільність у цій групі пацієнтів. Крім того, у хворих з відсутністю консолідації спостерігали також знижену оптичну щільність кіркового шару кістки реципієнта.
У разі застосування інтрамедулярного блокованого стрижня для фіксації кісткового алоімплантата ознак порушення процесу консолідації не відмічено, а вся кісткова тканина (кістки реципієнта та алоімплантат) з плином часу набувала більшої щільності.
Таким чином, застосування сегментарних кісткових алоімплантатів для заміщення післярезекційних дефектів довгих кісток, виконання фіксації алоімплантата за допомогою інтрамедулярного блокованого стрижня зменшує кількість ускладнень, пов’язаних з порушенням процесу консолідації алоімплантата та кістки реципієнта.
Висновки
1. Результати проведеного дослідження наочно висвітлили той факт, що при алокомпозитному ендопротезуванні довгої кістки виконання східцеподібної остеотомії для з’єднання кістки реципієнта з кістковим сегментарним алоімплантатом сприяє скорішому набуванню щільності кісткового регенерату.
2. Більш стабільна фіксація кісткового алоімплантата із кісткою реципієнта, а також збільшення площини контакту цих кісток завдяки використанню східцеподібної остеотомії кісток, що з’єднуються, обумовлюють отримання найбільшої оптичної щільності кісткового регенерату.
3. У разі застосування інтрамедулярного блокованого стрижня для фіксації кісткового алоімплантата ознак порушення процесу консолідації не відмічено, а вся кісткова тканина (кістки реципієнта та алоімплантат) з плином часу набувала більшої щільності.
4. Застосування сегментарних кісткових алоімплантатів для заміщення післярезекційних дефектів довгих кісток, виконання фіксації алоімплантата за допомогою інтрамедулярного блокованого стрижня зменшує кількість ускладнень, пов’язаних з порушенням процесу консолідації алоімплантата та кістки реципієнта.
Перспективи подальших досліджень. Планується продовження роботи над розробками методів алопластичного заміщення післярезекційних дефектів довгих кісток у пацієнтів зі злоякісними пухлинами.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Фінансування видатками Державного бюджету України. НДР «Розробити методики біореконструкції дефектів довгих кісток та суглобів при хірургічному лікуванні хворих з кістковими пухлинами» (2018–2020), номер держреєстрації 0118U003215.
Отримано/Received 04.07.2024
Рецензовано/Revised 15.07.2024
Прийнято до друку/Accepted 24.07.2024
Список литературы
1. Baldwin P., Li D.J., Auston D.A., Mir H.S., Yoon R.S., Koval, K.J. (2019). Autograft, allograft, and bone graft substitutes: clinical evidence and indications for use in the setting of orthopaedic trauma surgery. Journal of Orthopaedic Trauma, 33, 4, 203-213. https://doi.org/10.1097/BOT.0000000000001420.
2. Perez J.R., Jose J., Mohile N.V., Boden A.L., Greif D.N., Barrera C.M., Conway S., Subhawong T., Ugarte A., & Pretell-Mazzini J. (2020). Limb salvage reconstruction: Radiologic features of common reconstructive techniques and their complications. Journal of Orthopaedics, 21, 183-191. https://doi.org/10.1016/j.jor.2020.03.043.
3. Reif T., Schoch B., Spiguel A., Elhassan B., Wright T., Sanchez-Sotelo J., & Wilke B.K. (2020). A retrospective review of revision proximal humeral allograft-prosthetic composite procedures: An analysis of proximal humeral bone stock restoration. Journal of Shoulder and Elbow Surgery, 29(7), 1353-1358. https://doi.org/10.1016/j.jse.2019.10.029.
4. Sohn H.S., Oh, J.K. (2019). Review of bone graft and bone substitutes with an emphasis on fracture surgeries. Biomaterials Research, 23, 9. DOI: https://doi.org/10.1186/s40824-019-0157-y.
5. Gharedaghi M., Peivandi M.T., Mazloomi M., Shoorin H.R., Hasani M., Seyf P., Khazaee F. (2016). Evaluation of clinical results and complications of structural allograft reconstruction after bone tumor surgery. Arch Bone Joint Surgery, 4(3), 236-242. Retrieved from https://pubmed.ncbi.nlm.nih.gov/27517069/.
6. Crenn V., Quinette Y., Bouthors C., Missenard G., Viard B., Anract P., Boisgard S., Mascard E., & Gouin, F. (2022). Intercalary allograft reconstruction following femoral tumour resection: Mid- and long-term results and benefits of adding a vascularised fibula autograft. World Journal of Surgical Onco-logy, 20. https://doi.org/10.1186/s12957-022-02650-x.
7. Gundle K.R. (2020). CORR Insights®: Do Massive Allograft Reconstructions for Tumors of the Femur and Tibia Survive 10 or More Years After Implantation? Clinical Orthopaedics & Related Research, 478(3), 525-526. https://doi.org/10.1097/CORR.0000000000000856.
8. Jayaramaraju D., Venkataramani H., Rajasekaran R.B., Agraharam D., Sabapathy S.R., & Rajasekaran S. (2019). Modified Capanna’s Technique (Vascularized Free Fibula Combined with Allograft) as a Single-Stage Procedure in Post-traumatic Long-Segment Defects of the Lower End of the Femur: Outcome Analysis of a Series of 19 Patients with an Average Gap of 14 cm. Indian Journal of Plastic Surgery: Official Publication of the Association of Plastic Surgeons of India, 52(3), 296-303. https://doi.org/10.1055/s-0039-3400672.
9. Langlais F., & Tomeno B. (2012). Limb Salvage: Major Reconstructions in Oncologic and Nontumoral Conditions 5th International Symposium, St. Malo ISOLS-GETO. Springer Science & Business Media.
10. Вирва О.Е., Головіна Я.О., Малик Р.В., Карпінський М.Ю., Карпінська О.Д. (2020). Рентгенометричне дослідження щільності кісток у разі алокомпозитного ендопротезування (експеримент in vivo). Ортопедия, травматология и протезирование, (4), 18-24. https://doi.org/10.15674/0030-59872020418-24.
11. Головіна Я.О., Малик Р.В., Карпінський М.Ю., Карпінська О.Д. (2022). Дослідження рентгенологічної кісткової щільності у пацієнтів з кістковими пухлинами у разі застосування сегментарних кісткових алоімплантатів. Травма, 23 (1), 43-50. https://doi.org/10.22141/1608-1706.1.23.2022.881.
12. Європейська конвенція про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей. Страсбург, 18 березня 1986 року: офіційний переклад [Електронний ресурс]. Верховна Рада України. Офіц. веб-сайт (Міжнародний документ Ради Європи). Режим доступу до документа: http://zakon.rada.gov.ua/cgi-bin/laws/main.cgi?nreg=994_137.
13. Про захист тварин від жорстокого поводження: Закон України № 3447-IV вiд 21.02.2006 р. [Електронний ресурс]. Верховна Рада України. Офіц. веб-сайт. Режим доступу до документа: http://zakon.rada.gov.ua/cgi-bin/laws/main.cgi?nreg=3447-15.
14. Colangeli S., Andreani L., D’Arienzo A., Mani O., Restuccia G., & Capanna R. (2022). Biological Reconstruction of the Tibial Diaphysis and Ankle — III: Arthrodesis with Massive Allograft. В.H. Özger, F.H. Sim, A. Puri, & L. Eralp (eds.). Orthopedic Surgical Oncology For Bone Tumors: A Case Study Atlas (р. 333-343). Springer International Publishing. https://doi.org/10.1007/978-3-030-73327-8_32.
15. Garcia-Coiradas J., Garcia-Maroto R., Cebrian J.L., & Lopez-Duran L. (2015). Structural bone allograft fractures in oncological procedures. International Orthopaedics, 39(11), 2261-2265. https://doi.org/10.1007/s00264-015-2980-7.
16. Capanna R., Campanacci D.A., Belot N., Beltrami G., Manfrini M., Innocenti M., & Ceruso M. (2007). A new reconstructive technique for intercalary defects of long bones: The association of massive allograft with vascularized fibular autograft. Long-term results and comparison with alternative techniques. The Orthopedic Clinics of North America, 38(1), 51-60, vi. https://doi.org/10.1016/j.ocl.2006.10.008.
17. Dubina A., Shiu B., Gilotra M., Hasan S.A., Lerman D., & Ng V.Y. (2017). What is the Optimal Reconstruction Option after the Resection of Proximal Humeral Tumors? A Systematic Review. The Open Orthopaedics Journal, 11, 203-211. https://doi.org/10.2174/1874325001711010203.
/46.jpg)
/47.jpg)

/46.jpg)
/47.jpg)