Вступ
Йод є базовим мікроелементом для життя людини. Він існує в організмі людини в різних формах, наприклад таких, як атом йоду (I–), молекулярний йод (I2), трийодид (I3), аніон йоду (HI2O–) і йодзв’язуючі молекули (такі як йодоліпіди) [1]. I– є свого роду відновлюючим агентом, який може окиснюватися пероксидазними ферментами й брати участь в генерації тиреоїдних гормонів (ТГ). Трийодтиронін (Т3) і тироксин (Т4) є важливими регуляторами енергетичного обміну [1]. Недавні дослідження показали, що йод, окрім своєї ролі щодо щитоподібної залози, також функціонує як антиоксидант, імуномодулятор і диференціатор у різних органах і тканинах [2].
Метаболічний синдром (МС) визначається як комбінація метаболічних розладів, включно з абдомінальним ожирінням, артеріальною гіпертензією (АГ), дисліпідемією та гіперглікемією [3]. МС значно поширений у всьому світі та спричиняє серйозні проблеми, такі як серцево-судинні захворювання, пухлини й підвищення загальної смертності [4]. Розвиток МС включає багато факторів, дослідження вказують на те, що окиснювальний стрес і хронічні запальні стани відіграють життєво важливу роль [5]. Зміни в харчових звичках є ще одним фактором, що сприяє поширенню МС. Отже, фактори, пов’язані з МС, такі як споживання йоду, можуть частково пояснити виникнення МС.
У цьому огляді ми зосереджуємося на йоді та його зв’язку з метаболічними порушеннями, а також на пов’язаних з ним механізмах. Отримані дані допоможуть нам отримати всебічне розуміння ролі йоду і нададуть підтверджуючі докази щодо відповідних і безпечних стандартів споживання йоду.
Молекулярна основа екстратиреоїдних ефектів йоду
Симпортер йодиду натрію (NIS) є найбільш ефективним і специфічним транспортером I–, що експресується на епітеліальних клітинах фолікулів щитоподібної залози. Багато інших органів також можуть активно накопичувати йод, у тому числі слинні залози, шлунок, молочна залоза в період лактації, яєчники, простата і підшлункова залоза. На додаток до NIS і пендрину нещодавно було виявлено, що в цих органах експресуються нові транспортери йоду, включно з трансмембранним регулятором провідності кістозного фіброзу (CFTR), аноктаміном 1 (ANO1) і полівітамінним транспортером натрію (SMVT) [2]. Отже, сам йод чинить екстратиреоїдну дію на органи, які можуть його поглинати.
Джерела й безпечна концентрація йоду
З метою ліквідації йододефіцитних захворювань у більшості країн запроваджено загальне йодування солі. Однак через споживання йодованої солі або питної води, тваринного молока, збагачених йодом, певних видів морських водоростей, йодовмісних дієтичних добавок, а також їх комбінації може виникнути надмірне споживання йоду. Деякі фармацевтичні препарати (наприклад, аміодарон), дезінфікуючі засоби та йодовмісні контрастні засоби також можуть бути джерелами йоду [6]. У нормі засвоюється понад 90 % харчового йоду [7]. Рекомендоване –споживання йоду з їжею становить 150–299 мкг/день [8, 9]. І відповідно, діапазон середньої концентрації йоду в сечі (mUIC) має становити 100–299 мкг/л. Середнє споживання йоду в Японії становить 1200 мкг/день, що в 7,2 раза вище, ніж у британців, і в 5,7 раза більше, ніж в американців [10]. Надлишок йоду може збільшити ризик гіпертиреозу і субклінічного гіпотиреозу [11]. Проте люди з нормальною функцією щитоподібної залози зазвичай толерантні до захворювань щитоподібної залози, викликаних йодом, оскільки функція щитоподібної залози в них швидко нормалізується після припинення надмірного споживання йоду [8, 12]. Деякі епідеміологічні дослідження показали, що помірно високе споживання йоду є корисним для зниження захворюваності на рак молочної залози й простати [13–15].
Клінічні дослідження кореляції між йодним статусом і метаболічними порушеннями
Останні дослідження вивчили вплив самого йоду на поширеність метаболічних розладів. Більшість клінічних досліджень були опубліковані протягом останніх 5 років. Для оцінки стану йодного забезпечення використовували різні показники, включно з концентрацією йоду в сечі (UIC), концентрацією йоду у воді (WIC) і добовим споживанням йоду. Однак через використання різних показників для оцінки споживання йоду, різні діагностичні критерії метаболічних розладів, а також різницю у віці та статі суб’єктів дослідження не дали узгоджених результатів. Репрезентативні дослідження взаємозв’язку між йодом і метаболічними порушеннями підсумовані в табл. 1.
Йод і метаболічний синдром
У перехресних дослідженнях було встановлено, що зв’язок між UIC і поширеністю МС обернено пов’язаний або демонструє U-подібну криву з найнижчою точкою, що спостерігається при UIC 300–499 мкг/л [24, 26]. Проспективне дослідження показало, що споживання йоду та морських водоростей з їжею було обернено пов’язане із захворюваністю на МС у корейських жінок у постменопаузі [19]. Крім того, споживання великої кількості морських водоростей було негативно пов’язане із захворюваністю на МС у чоловіків з генотипами TG і TT гена ліпопротеїнліпази (LPL) rs17482735 [31]. Однак інше перехресне дослідження, проведене в дітей шкільного віку та їхніх батьків, виявило асоціацію між високою UIC і МС [30].
Йод та ожиріння
У великому епідеміологічному дослідженні (TIDE), проведеному в Китаї, поширеність центрального ожиріння значно зменшувалася, коли UIC становила 300 мкг/л або вище. Співвідношення шансів (OR) для центрального ожиріння з UIC > 800 мкг/л становило 0,797 (p < 0,05) [24]. Серед дітей шкільного віку в Китаї діти з надмірною вагою демонстрували нижчу UIC порівняно з дітьми з нормальною вагою [32]. Жінки з ожирінням також продемонстрували вірогідно нижчу UIC порівняно з ними самими після баріатричної хірургії та жінками з нормальною вагою [33]. У рандомізованому контрольованому дослідженні в осіб, які вживали таблетки, що містять порошок ламінарії зі зниженим вмістом йоду, відсоток жирової тканини вірогідно зменшувався порівняно з тими, хто приймав плацебо [34]. У 4-тижневому плацебо-контрольованому дослідженні додавання фукоксантину з морських водоростей (1 мг/день) зменшувало окружність талії і масу жиру в японців з ожирінням. Крім того, при прийомі фукоксантину (3 мг/день) зменшилися кількість вісцерального жиру, індекс маси тіла (ІМТ) і вага [35]. Проте mUIC була позитивно пов’язана з ожирінням серед колумбійських жінок репродуктивного віку [36].
Йод і гіперглікемія
Зв’язок між UIC і поширеністю діабету показав U-подібну криву в дослідженні TIDE [24]. У когортному дослідженні за участю 71 264 жінок було виявлено, що люди з високим рівнем споживання йоду мають вищий ризик розвитку цукрового діабету (ЦД) 2-го типу порівняно з особами з недостатнім споживанням йоду [18]. Дорослі, які проживають в регіонах з достатнім (IS, mUIC 200–299,99 мкг/л) і надмірним (IE, mUIC > 300 мкг/л) йодозабезпеченням, демонстрували вищі рівні глюкози в крові порівняно з тими, хто проживає в регіоні з адекватним йодозабезпеченням (IA, mUIC 100–199,99 мкг/л) [23]. Також повідомлялося, що низька UIC пов’язана з підвищеним ризиком гіперглікемії натще в жінок [27]. Дослідження показало, що пацієнти із цукровим діабетом 2-го типу мали нижчі рівні UIC порівняно зі здоровими людьми. Крім того, UIC продемонструвала негативну кореляцію з резистентністю до інсуліну в осіб із ЦД 2-го типу [37]. Однак у 4-тижневому клінічному дослідженні додавання морських водоростей (48 г/день) знизило рівень глюкози в крові в корейських пацієнтів із ЦД 2-го типу [38].
Вищий рівень йоду може потенційно захистити від гіперглікемії під час вагітності. Дослідження показало, що вагітні та жінки, які годують груддю, у зоні з надмірним йодозабезпеченням (mWIC > 300 мкг/л) мали нижчий рівень глюкози в крові та меншу поширеність гіперглікемії [29]. Крім того, у дослідженні за участю 471 вагітної жінки більш висока концентрація йоду в плаценті була пов’язана зі зниженням частоти гестаційного цукрового діабету [20]. Проте Bell et al. не виявили жодної кореляції між UIC і поширеністю гестаційного ЦД [39].
Йод і гіпертензія
У дослідженні TIDE вчені спостерігали U-подібну криву зв’язку між UIC і поширеністю гіпертонії. Найнижча точка була виявлена в діапазоні UIC 300–499 мкг/л [24]. Два дослідження, проведені в Китаї, показали, що дорослі в регіонах з достатнім і надмірним йодозабезпеченням демонстрували вищий рівень артеріального тиску порівняно з тими, хто мешкав в регіоні з адекватним йодозабезпеченням [23, 29]. Тим часом дефіцит йоду було визначено як фактор ризику прееклампсії та гіпертонічної хвороби у вагітних [40]. Проте рандомізоване дослідження типу «випадок — контроль», проведене у 36-літніх японців з АГ, показало, що споживання вакаме (Undaria pinnatifida) (5 г/день) у складі бурих водоростей вірогідно знижувало артеріальний тиск [41].
Йод і дисліпідемія
Національне дослідження здоров’я та харчування (NHANES) 2007–2012 показало, що особи з найнижчим децилем UIC більш схильні до ризику підвищення рівня загального холестерину (скориговане співвідношення шансів (aOR) = 1,51) і холестерину ліпопротеїдів низької щільності (ЛПНЩ) (aOR = 1,58) порівняно з тими, хто має найвищий дециль UIC [21]. У США підлітки з низькою UIC мали вірогідно вищий ризик гіперхолестеринемії, підвищеного рівня ліпопротеїдів низької та дуже низької щільності порівняно з підлітками з нормальною UIC [22]. У рандомізованих клінічних дослідженнях повідомлялося, що добавки йоду знижували частоту гіперхолестеринемії в жінок з надмірною масою тіла [42], а також знижували рівень холестерину ЛПНЩ у сироватці крові в дорослих японців з надмірною масою тіла [34]. Додавання морських водоростей підвищило рівень холестерину ЛПВЩ і знизило рівень тригліцеридів у корейських пацієнтів із ЦД 2-го типу [38]. Метааналіз виявив, що споживання бурих морських водоростей вірогідно знизило рівні загального холестерину (середня різниця (MD): –3,001; 95% довірчий інтервал (ДІ): від –5,770 до –0,232) і холестерину ЛПНЩ (MD: –6,519; 95% ДІ: від –12,884 до –0,154) [43]. Однак існує спостережне дослідження з протилежним висновком [23]. Два дослідження показали, що зв’язок між йодним статусом і дисліпідемією має вигляд U-подібної [24] або оберненої U-подібної кривої [28].
Йод і гіперурикемія та подагра
На сьогодні про взаємозв’язок було повідомлено лише в одному епідеміологічному дослідженні, яке виявило обернений зв’язок між UIC і поширеністю гіпер–урикемії та подагри. Групи осіб з достатнім і надмірним йодозабезпеченням мали нижчу ймовірність гіперурикемії та подагри порівняно з групою осіб з адекватним йодозабезпеченням [25].
Йод і ризик смерті
Дані поздовжніх досліджень вказують на підвищену смертність в осіб з йододефіцитом (UIC < 100 мкг/л) після поправки на змішані фактори. Співвідношення ризиків (HR) для смерті від усіх причин становило 1,29 в осіб з UIC 50–99 мкг/л і 1,71 в осіб з UIC менше за 50 мкг/л. Надлишок йоду не підвищує ризик смерті [17]. Однак дослідження NHANES III повідомило про суперечливі результати. У середній період спостереження, який тривав 19,2 року, наявність UIC понад 400 мкг/л вказувала на підвищений ризик (HR = 1,19) смерті від усіх причин. Не спостерігалося кореляції між низькою UIC і підвищеним ризиком смерті [16].
Основні дослідження кореляції між йодом і метаболізмом
Клінічні дослідження показали, що харчування, багате на йод, впливає на обмін речовин. Однак механізм цих ефектів ще недостатньо вивчений і потребує подальших досліджень. Через різні дози йоду, що призначалися, різну тривалість втручання, експериментальні дослідження на тваринах і рівні гормонів щитоподібної залози щодо результатів різних досліджень in vivo не вдалося досягти консенсусу. Kroupova et al. виявили, що споживання йоду може призвести до дозозалежного підвищення рівня холестерину в крові курей [44]. Дослідження показало, що надлишок йоду (2,4 і 4,8 мг/л) може викликати стеатоз печінки в мишей BaLB/c залежно від дози [45]. Проте було виявлено, що більш високе споживання йоду сприяло метаболізму ліпідів у мишей без істотних відмінностей у рівнях тиреоїдних гормонів і масі тіла між різними групами [46]. Дефіцит йоду збільшив внесок жиру у витрати енергії через підвищений тиреотропін (ТТГ) у самців мишей [47]. Дослідження метаболізму повторного введення йодиду калію в дорослих самців щурів показало метаболічний зсув у щитоподібній залозі. Цей зсув також спостерігався в плазмі та сечі, і метаболіти були залучені до участі в шляхах регуляції метаболізму, амінокислот з розгалуженим ланцюгом, оксидантного стресу і відповіді, пов’язаної із запаленням [48].
Екстратиреоїдні механізми йоду
Йод є мікроелементом, який має протимікробні властивості. Лікування йодом мишей з ожирінням продемонструвало ефект зниження ваги і змінило кишкову мікробіоту, що призвело до збільшення кількості патогенних бактерій і зменшення кількості корисних бактерій. І навпаки, у мишей з нормальною вагою спостерігалися контрастні моделі відповіді [49]. Інше дослідження виявило значний зв’язок між використанням повідон-йодної дезінфекції вульви і колонізацією мікробіоти порожнини рота новонароджених [50]. Крім того, мікробіота кишечника також сприяла всмоктуванню йоду [51]. Тому ймовірно, що йод впливає на метаболізм, змінюючи мікробіоту.
Існує багато доказів того, що йод має екстратиреоїдну дію як антиоксидант, особливо при захворюваннях молочної залози та деяких пухлинах [14]. Виявлено, що йодид дуже ефективний у поглинанні активних форм кисню, таким чином зменшує шкоду, спричинену вільними радикалами кисню [52]. У жінок, які годують груддю, вміст йоду в грудному молоці демонструє негативну кореляцію з активністю каталази, супероксиддисмутази (SOD) і глутатіонпероксидази (GSH-Px), а також з рівнями адипонектину [53]. Як гормон, пов’язаний з ожирінням, адипонектин також відіграє вирішальну роль у регуляції чутливості до інсуліну. Додавання морських водоростей підвищило активність антиоксидантних ферментів у клінічному дослідженні корейських пацієнтів із ЦД 2-го типу [38].
Вживання добавок йоду від 100 до 300 мкг/день підвищувало загальний антиоксидантний статус у сироватці крові людини [54]. Однак нещодавно опубліковане дослідження показало, що надмірні рівні йоду призводять до пригнічення росту клітин, окиснювального стресу і клітинного апоптозу в бета-клітинах підшлункової залози [55]. За рахунок регуляції окиснювального статусу йод пов’язаний зі змінами чутливості до інсуліну або метаболізму.
Хронічний запальний стан прокладає шлях до розвитку метаболічних порушень. Йод також має добре відомі протизапальні й імуномодулюючі ефекти. Як пендрин, так і NIS експресуються на поверхні лейкоцитів людини. Застосування йодиду натрію (NaI) щодо лейкоцитів привело до вірогідного підвищення вироблення як про-, так і протизапальних цитокінів [56]. Вживання добавок йоду мало незначний вплив на плазмову концентрацію маркерів запалення і білків гострої фази [54]. Пероральний прийом йодиду калію (15 мг/кг/день протягом 3 днів) вірогідно пригнічував хемотаксис нейтрофілів у периферичній крові [57]. Fernando et al. надали короткий виклад поточного розуміння потенційних протизапальних властивостей похідних морських водоростей [58]. Показано, що вони зменшують запалення, впливаючи на різні клітинні механізми, зокрема інгібування прозапальних ферментів, таких як циклооксигеназа-2 (ЦОГ-2) та індуцибельна синтаза оксиду азоту (iNOS), модулювання шляхів протеїнкінази, що активується мітогеном, і блокування активації ядерного фактора каппа-B (NF-κB) [59]. Шлях проте–їнкінази, що активується мітогеном, конт–ролює процеси клітинного росту і мітоз. Крім того, це має вирішальне значення для стійкості до інсуліну [60]. Передача сигналів NF-κB особливо актуальна при захворюваннях, пов’язаних із запаленням, включно з метаболічними розладами. Отже, імовірно, що йод може впливати на метаболізм шляхом модуляції хронічного запалення.
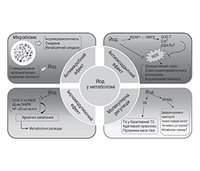
/11.jpg)
I2 виявляв антипроліферативну й апоптотичну дію на моделях раку молочної залози [61] через утворення йодовмісних ліпідів (6-IL) і збільшення експресії γ-рецептора, що активується проліфератором пероксисом (PPARγ) [62, 63]. PPARγ, що експресується переважно в жировій тканині, сприяє диференціації адипоцитів, поглинанню жирних кислот, зберіганню тригліцеридів у ліпідних краплях. Це підвищує чутливість до інсуліну і метаболізм глюкози [64]. PPARα, PPARβ/δ і PPARγ є трьома ідентифікованими ізоформами PPAR. У табл. 2 подано узагальнені відповідні дослідження зв’язку між йодом і PPAR. Крім того, надмірне введення йоду вірогідно перешкоджало активності дейодинази 2-го типу (D2) у різних органах, таких як гіпофіз, печінка і нирки [71–73]. D2 відповідає за перетворення Т4 на біоактивний Т3, який, у свою чергу, сприяє адаптивному термогенезу й бере участь у підтримці ваги [74]. На рис. 1 подано огляд потенційних механізмів впливу йоду на метаболізм.
Висновки
Цей огляд підтверджує, що йод впливає на метаболізм глюкози, ліпідів і ожиріння. Вплив йоду можна пояснити його антиоксидантними й імуномодулюючими властивостями. Хоча зв’язок між йодом і метаболізмом суперечливий, як дефіцит йоду, так і тривалий надлишок йоду є фактором ризику розладів щитоподібної залози. Важливо підтримувати йодний статус населення в оптимальному діапазоні. Потрібні подальші проспективні дослідження і дослідження механізмів для встановлення безпечного стандарту йодного харчування, заснованого на доказах.
Оригінал статті надруковано
у Front. Nutr. 2024;11:1346452.
doi: 10.3389/fnut.2024.1346452